Katalytische Verfahren spielen in der Chemieindustrie eine zentrale Rolle. Im Mittelpunkt stehen dabei Katalysatoren, also Substanzen, die chemische Umwandlungsprozesse auslösen. Um diese Vorgänge zu steuern, kommt es auch auf die Trägermaterialien für die Katalysatoren an. Dr. Melanie Iwanow, Wissenschaftlerin am Fraunhofer IGB, geht in ihrem Blog-Beitrag der Frage nach, was geträgerte Katalysatoren sind und wie sie sich produzieren lassen – auch auf biologischer Basis. Ein Beispiel dafür ist Aktivkohle als Trägermaterial, welche nicht nur aus fossiler Kohle oder aus Holz hergestellt werden kann, sondern mit einer am Fraunhofer IGB entwickelten Methode auch aus grünen Lösungsmitteln – für mehr Nachhaltigkeit in der Chemiebranche.
Die Unabhängigkeit von fossilen Rohstoffen wird durch die drängenden Fragen der Rohstoffwende und des Klimawandels sowie auch die geopolitische Lage heutzutage immer wichtiger. Deswegen können biobasierte Alternativen die Lösung sein! Doch »biobasiert« allein ist meist wenig überzeugend. Es ist wichtig, biobasierte alternative Materialien oder Produkte zu finden, die sich gegenüber den herkömmlichen Ansätzen, die auf fossilen Ressourcen basieren, durch zusätzliche vorteilhafte Eigenschaften auszeichnen. Im Allgemeinen ist aufgrund ökonomischer Erwägungen der Preis bestehender Produkte der Chemieindustrie ein oft angeführtes Argument, das innovative Entwicklungen hemmt. Doch die Überwindung von funktionalen und techno-ökonomischen Limitierungen und der hiermit generierte Mehrwert neuer Produkte kann helfen, neue biobasierte Lösungen auf dem Markt zu etablieren. Im Folgenden möchte ich erklären, welche Rolle Trägermaterialien für Katalysatoren dabei spielen und was eine am Fraunhofer IGB entwickelte biobasierte Katalysemethode in diesem Zusammenhang so besonders macht.
Was sind eigentlich »geträgerte Katalysatoren«?
Katalyse wird in ihrer Vielfältigkeit als Zukunftstechnologie betrachtet und spielt als technisches Prinzip für die Konversion von Stoffen in einen anderen (durch Reaktion mit einem anderen Stoff) eine wesentliche Rolle in industriellen Syntheseverfahren. Somit ist sie auch für die Bioökonomie von zentraler Bedeutung. Heutzutage stellen über 90 Prozent aller chemischen Prozesse katalytische Verfahren dar. Der Weltmarkt für Katalysatoren umfasst etwa 10 Milliarden Euro.[1] Davon fällt der größte Teil unter den Begriff »heterogene Katalyse«. Das bedeutet, dass der Katalysator und die zu reagierenden Stoffe in unterschiedlichen Aggregatzuständen vorliegen − fest, flüssig oder gasförmig. Im Gegensatz dazu steht die »homogene Katalyse«, bei der der Katalysator und die reagierenden Stoffe im gleichen Aggregatszustand vorliegen.
In der heterogenen Katalyse ist Oberfläche alles: Denn die entscheidenden chemischen Vorgänge bei heterogen katalysierten Prozessen spielen sich an der Oberfläche des Katalysators ab. Bei Metallkatalysatoren beispielsweise bestimmt die aktive Metallkomponente an der Katalysatoroberfläche die wesentlichen Leistungsmerkmale des Katalysators: die Selektivität und die Aktivität.[1] Dazu werden häufig sehr kleine Teilchen mit einer dementsprechend großen spezifischen Oberfläche des aktiven Metalls auf einem Trägermaterial aufgebracht.[2] So werden die kleinen Metallpartikel stabilisiert und damit auch wertvolle Katalysatorsubstanzen eingespart.[3] Grundsätzlich gibt das Trägermaterial dem Katalysator seine Form, die mechanische Festigkeit und durch eine poröse Struktur eine große Oberfläche. In industriellen Prozessen liegt der heterogene Katalysator meist als Feststoff vor, Gase oder Flüssigkeiten werden als Reaktionspartner eingesetzt. Dadurch kann der Katalysator leicht von Reaktanden und Produkten abgetrennt werden. Zudem lassen sich die während der Prozesse deaktivierten Katalysatoren einfach aufarbeiten oder die aktiven Komponenten zurückgewinnen und wieder für die Herstellung neuer Katalysatoren einsetzen.[2]
Aufgrund des günstigen Preises und der thermischen Stabilität ist das am häufigsten verwendete Trägermaterial γ-Tonerde (Alumina, Al2O3). Andere häufig verwendete Trägermaterialien sind Kieselerde (Silica, SiO2) und Aktivkohle.[4] Bei Aktivkohle handelt es sich um ein Kohlenstoffmaterial mit hoher Porosität und dadurch großer Oberfläche. Die Verwendung von Aktivkohle als Träger für Metallkatalysatoren weist mehrere Vorteile auf: a) Die Kohlenstoffoberfläche ist reaktionsträge, insbesondere unter stark sauren und basischen Bedingungen. b) Die Porengrößenverteilung sowie die chemischen Eigenschaften auf der Oberfläche können je nach geplanter Anwendung angepasst werden (Polarität und Hydrophobie). c) Zusätzlich können Metallpartikel durch einfaches Verbrennen des Kohlenstoffträgers zurückgewonnen werden.[2, 5]
Wie werden »geträgerte Katalysatoren« überhaupt hergestellt?
Industriell umfasst die Herstellung von Trägermaterialien und die anschließende Beladung mit Metallen mehrere Schritte.[6] Abhängig von den verwendeten Ausgangsmaterialien ist vor dem Kalzinierungsschritt eine Vorbehandlung nötig.[7] Die Aktivkohle wird durch Kalzinierung, sprich einem Erhitzen unter Luft, und zusätzlicher Aktivierung hergestellt. Dazu wird hauptsächlich die physikalische oder chemische Aktivierung verwendet. Der Unterschied der beiden Herstellungsmethoden liegt darin, dass bei der physikalischen Aktivierung das kohlenstoffhaltige Material erst kalziniert und anschließend durch Kohlenstoffdioxid oder Wasserdampf bei hohen Temperaturen aktiviert wird. So wird eine große Oberfläche in zwei Schritten erreicht. Bei der chemischen Aktivierung ist dagegen nur ein Schritt notwendig. Ein Aktivierungsreagenz − wie z. B. Phosphorsäure – wird bereits dem Ausgangsmaterial beigemischt und Kalzinierung und Aktivierung laufen somit in einem Schritt ab.[8] Jedoch muss das Aktivierungsreagenz im Anschluss durch mehrere Waschschritte entfernt werden.
Für die anschließende Beladung der Aktivkohle mit Metallverbindungen sind zudem bestimmte Eigenschaften der Aktivkohle nötig, welche durch eine gezielte Anpassung der Aktivkohlenoberfläche erreicht wird. Die verwendete Metallausgangsverbindung wird durch Adsorption an die Oberflächengruppen der Aktivkohle angelagert. Ein anschließender Aktivierungsschritt liefert den aktiven geträgerten Metallkatalysator.[9] Die am häufigsten verwendeten Rohstoffe für die Aktivkohleherstellung sind neben fossiler Kohle auch beispielsweise Kokosnussschalen und Holz.[10] In der Literatur werden auch unzählige Publikationen zur Aktivkohleherstellung aus landwirtschaftlichen Abfällen oder aus Biomasse beschrieben. Hier spielt auch der Kreislaufgedanke nach dem Vorbild der Natur eine zentrale Rolle und macht die Katalyse in diesem Sinne biointelligent. Bei allen bisherigen biobasierten Alternativen erfordern diese jedoch genau wie bei fossil-basierten Ausgangsstoffen einen hohen Energieeintrag und eine aufwendige Herstellung.[11]
Neu entwickelte biobasierte Methode
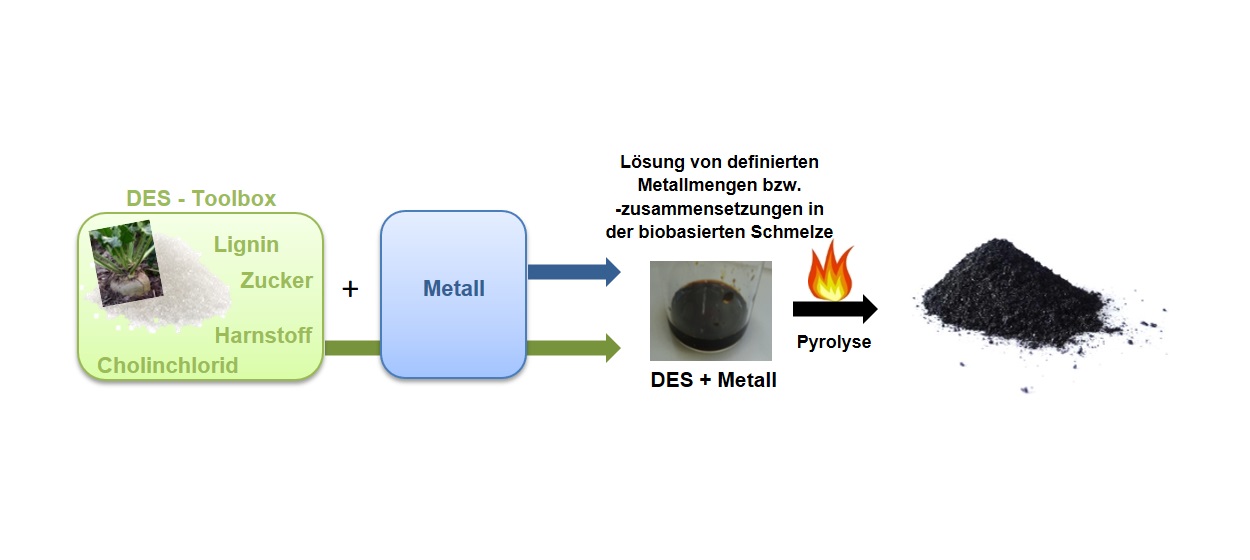
Abbildung 1 veranschaulicht die Vorgehensweise bei einer am Fraunhofer IGB entwickelten und eingesetzten einfachen Herstellungsmethode für geträgerte heterogene Metallkatalysatoren. Der Clou ist der Einsatz von sogenannten tiefeutektischen Mischungen (Deep Eutectic Solvents, kurz DES).
Die Idee, biobasierte und somit »grüne« Trägermaterialien für heterogene Metallkatalysatoren zu nutzen, beruht auf der sehr guten Löslichkeit von Metallverbindungen und Metalloxiden in tiefeutektischen Mischungen. Diese bestehen aus biogenen organischen Verbindungen wie z. B. Zuckern und Harnstoff. Dadurch können die gewünschten Metallkomponenten im gewünschten Verhältnis in DES gelöst bzw. homogen verteilt werden. Die gesamte DES-Metall-Mischung wird schließlich unter definierten Bedingungen erhitzt. In diesem Pyrolyse genannten Erhitzungsschritt entsteht in einem einfachen einstufigen Verfahren direkt ein maßgeschneiderter und aktiver geträgerter Metallkatalysator. Die kohlenstoffhaltigen organischen Verbindungen der DES dienen dabei als Kohlenstoffquelle, aus dem ein Aktivkohle-ähnliches Trägermaterial entsteht, welches durch den Erhitzungsprozess hergestellt wird.
… und welche Vorteile bietet die neu entwickelte Methode?
Durch diese Methode wird eine deutliche Zeit- und Kostenersparnis gegenüber herkömmlichen mehrstufigen Verfahren erreicht. Zusätzlich erfüllen die verwendeten DES alle Prinzipien der »Grünen Chemie«, was einen Beitrag zu nachhaltigeren Prozessen für die Zukunft leistet. Unsere Art der Herstellung von Trägermaterialien für heterogene Metallkatalysatoren tritt nicht in Konkurrenz zu Nahrungs- oder Futtermitteln, da hauptsächlich Mischungen aus nicht als Nahrungsmitteln geeigneten nachwachsenden Rohstoffen, Biomasse oder Reststoffen (z. B. Lignin) eingesetzt werden.[12] Die Zusammensetzung und Eigenschaften der Trägermaterialien und die Beladung mit den gewünschten Metallen lassen sich einfach anhand der Auswahl der Komponenten für das DES maßschneidern. Abschließend lassen sich durch unsere Methode sogar die eingangs erwähnten Limitierungen überwinden. Es wird ein ganz neuer »Katalysatorraum« zugänglich. Unsere Methode ermöglicht die Nutzung des ganzen Spektrums an Metallen in jeglichen gewünschten Mengen oder Verhältnissen für den Einsatz in der heterogenen Katalyse − geträgert auf den neuartigen Bio-Trägermaterialien. In Tabelle 1 werden die Herstellungsmethoden aus DES und die herkömmlichen Herstellungsverfahren verglichen, wodurch die Vorteile der »grünen« Methode noch einmal unterstrichen werden.
| Grüne Trägermaterialien aus DES | Herkömmliche Herstellung[2,13] |
|
|
|
|
|
|
|
|
|
|
Unseren Kunden aus der Chemieindustrie bieten wir mit unserem exklusiven Know-how bei der Herstellung von alternativen biobasierten Katalysator-Trägermaterialien innovative und maßgeschneiderte Lösungen an. Wollen auch Sie ihre Prozesse nachhaltiger gestalten und optimieren? Kontaktieren Sie uns! Wir freuen uns auf Ihre Anfrage.
Literatur:
[1] https://analyticalscience.wiley.com/do/10.1002/gitfach.10848, abgerufen am 18.05.2022.
[2] Auer, E.; Freund, A.; Pietsch, J.; Tacke, T. Applied Catalysis A: General 1998, 173 (2), 259-271.
[3] https://www.ceramtec-industrial.com/de/katalysatortraeger, abgerufen am 18.05.2022.
[4] J.W. Geus und J. van Dillen, in: G. Ertl, H. Knözinger, F. Schüth, J. Weitkamp (Editors.), Handbook of Heterogeneous Catalysis, Vol. 1, VCH, Weinheim, 2008, p. 428ff.
[5] Rodŕíguez‐Reinoso, F.; Seṕulveda‐Escribano, A. Carbon as Catalyst Support. In Carbon Materials for Catalysis; 2008; pp 131-155.
[6] Yang, J.; Yue, L.; Lin, B.; Wang, L.; Zhao, Y.; Lin, Y.; Chang, K.; DaCosta, H.; Hu, X. Energy & Fuels 2017, 31 (10), 11060-11068.
[7] Lillo-Ródenas, M. A.; Cazorla-Amorós, D.; Linares-Solano, A. Carbon 2003, 41 (2), 267-275.
[8] Perrin, A.; Celzard, A.; Albiniak, A.; Kaczmarczyk, J.; Marêché, J. F.; Furdin, G. Carbon 2004, 42 (14), 2855-2866.
[9] Pietrzak, R. Fuel 2009, 88 (10), 1871-1877.
[10] Pietrzak, R.; Jurewicz, K.; Nowicki, P.; Babeł, K.; Wachowska, H. Fuel 2007, 86 (7), 1086-1092; Pietrzak, R.; Wachowska, H.; Nowicki, P.; Babeł, K. Fuel Processing Technology 2007, 88 (4), 409-415.
[11] Lillo-Ródenas, M. A.; Cazorla-Amorós, D.; Linares-Solano, A.; Béguin, F.; Clinard, C.; Rouzaud, J. N. Carbon 2004, 42 (7), 1305-1310.
[12] A. Paiva, R. Craveiro, I. Aroso, M. Martins, R. L. Reis, A. R. C. Duarte, ACS Sustainable Chemistry & Engineering 2014, 2, 1063.
[13] https://dechema.de/dechema_media/Downloads/Max_Buchner/2012/AB_2877.pdf, abgerufen am 18.05.2022.

