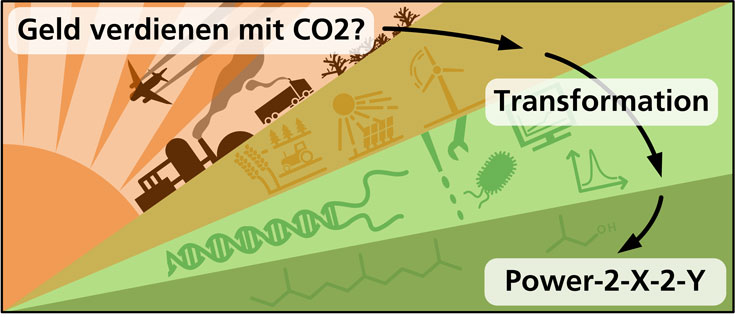
An der Tankstelle wird uns die Abhängigkeit von fossilen Ressourcen durch die hochschnellenden Preise bewusst. Denn insbesondere der Energiesektor ist zurzeit betroffen von steigenden Kosten am fossilen Rohstoffmarkt. Und ebenso die chemische Industrie, die Energie neben Öl und Gas als Rohstoff für viele ihrer zahlreichen Produkte benötigt. Wie können wir also unabhängiger werden von fossilen Rohstoffen und gleichzeitig chemische Produkte klimaneutral produzieren? Ein Teil der Antwort können Kaskadenprozesse sein, die CO2 aufwerten: Power-to-X-to-Y.
Wie aus CO2 die wichtigen Zwischenprodukte Synthesegas, Ameisensäure oder Methanol hergestellt werden, fasst der letzte Beitrag dieser Reihe zusammen. Im aktuellen Beitrag wird der nächste Schritt beleuchtet: Wie können wir mithilfe von Mikroorganismen und biotechnologischen Prozessen aus diesen Zwischenprodukten zahlreiche chemische Wertstoffe gewinnen?
Am Anfang der Biotechnologie standen Brot und Bier. Heute sind es bereits eine Vielzahl an chemischen Grundstoffen wie organische Säuren (z. B. Zitronen- und Essigsäure), Aminosäuren (Lysin und Glutamat), Antibiotika oder sogar Insulin. Gemein haben diese Produkte, dass sie mithilfe von Mikroorganismen hergestellt werden. Dabei spielt das bekannte Darmbakterium Escherichia coli eine Hauptrolle. In biotechnologischen Prozessen, genannt Fermentationen, werden diese winzigen Organismen gewinnbringend eingesetzt. Dabei wandeln sie passende Nahrung (heutzutage noch meistens Zucker) über ihren Stoffwechsel in zahlreiche werthaltige Verbindungen um. Doch diese Art der Fermentation benötigt fruchtbares Ackerland für die Zuckerproduktion. Dadurch herrscht eine Konkurrenz zur Nahrungsmittelherstellung.
Hier setzen unsere Power-to-X-to-Y-Prozesse an, die letztlich CO2 nutzen und somit unabhängig von einer Nutzung fruchtbarer Flächen sind. Damit ist die Übertragung in sehr große Maßstäbe, um viele Tonnen Produkt herzustellen, einfach möglich. Der Schlüssel für diesen Ansatz sind Mikroorganismen, die in der Lage sind, Synthesegas, Ameisensäure oder Methanol in wertvolle chemische Verbindungen umzuwandeln.
Welche Möglichkeiten gibt es also? Und welche Produkte werden bereits produziert? Das wird in diesem Beitrag zusammengefasst.
Vom Synthesegas zum Biokraftstoff
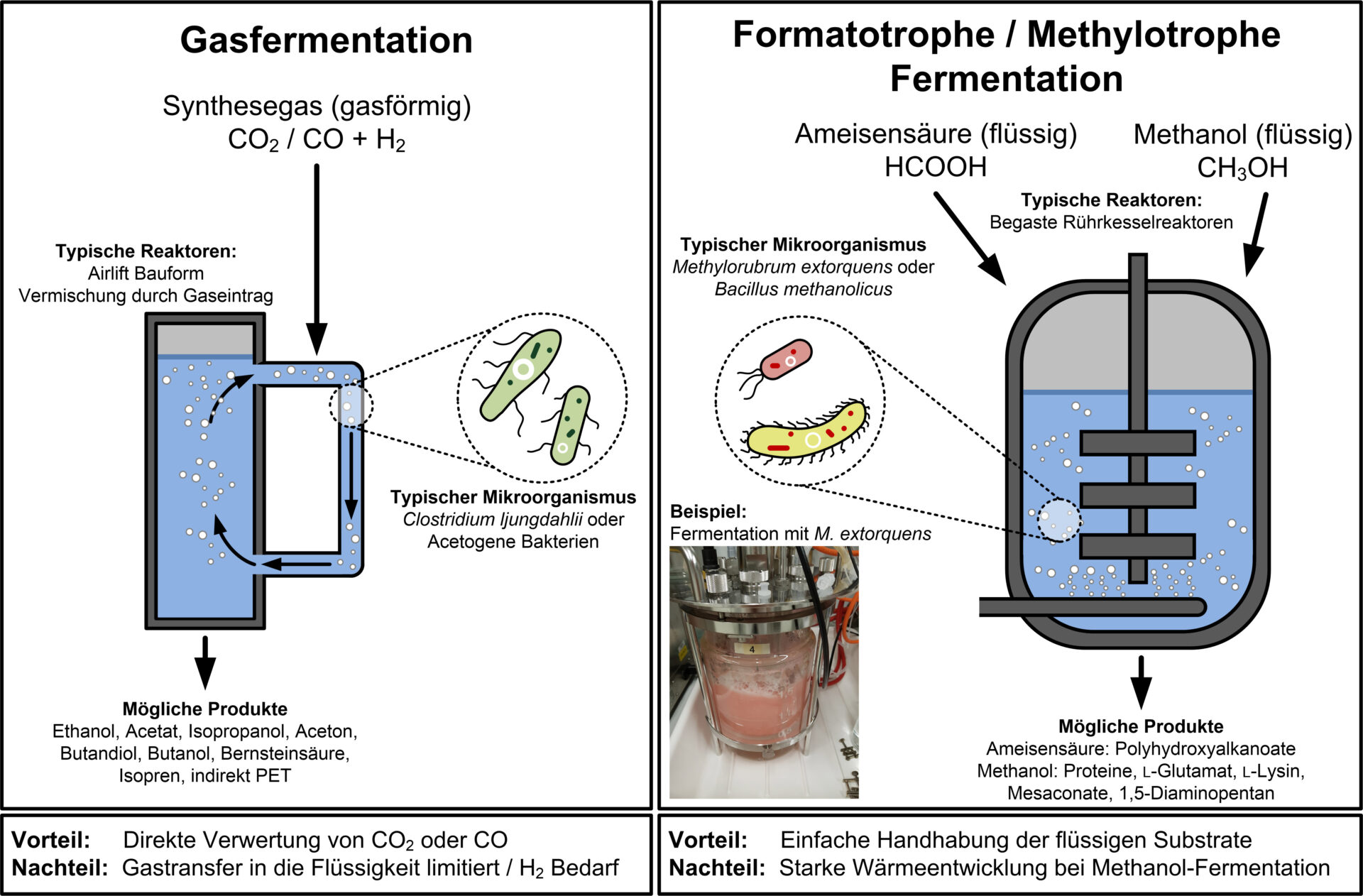
Ein Vorteil von Synthesegas – ein Gasgemisch aus CO2, CO und H2 – liegt in den vielseitigen Einsatzmöglichkeiten in der chemischen Industrie. Aber auch in der Biotechnologie werden verstärkt Prozesse erforscht, die dieses für den Menschen giftige Gemisch in Wertprodukte umwandeln. Insbesondere die Gasfermentation. Hierbei setzen Bakterien (hauptsächlich Clostridien) das Synthesegas in einem geeigneten Bioreaktor zu vielfältigen Produkten um. Die Firma Lanzatech aus den USA ist Vorreiter in dieser Technologiesparte. Die 2005 gegründete Firma fokussiert ihr Geschäftsmodell auf die Nutzung von industriellen Abgasen unter anderen aus Stahlwerken, die CO2, CO und H2 (also Synthesegas) enthalten. Das Ziel ist genauso klar wie clever: CO2-Emissionen reduzieren und gleichzeitig den Kohlenstoff in einem wertigen Produkt neu nutzen. Das ist „recycled carbon“.1
Das erste Produkt aus industriellen Abgasen, das Lanzatech anbieten konnte, ist Ethanol. Ethanol ist als Grundchemikalie bekannt und hat vielfältige Einsatzzwecke, z. B. bei der Desinfektion. Das weltweite Produktionsvolumen beläuft sich auf ca. 80 – 90 Millionen Tonnen.2 Vielversprechend ist, dass der Lanzatech-Prozess im Vergleich zu fossilen Alternativen rund 50 bis 70 Prozent der Treibhausgasemissionen vermeidet.3.4 Zusätzlich ist die Lanzatech-Prozesseffizienz den meisten Bio-Ethanol Produktionsprozessen – z.B. Maiszucker-Fermentation mit Bierhefe – überlegen.3
Aber nicht nur Ethanol ist im Produktportfolio: Lanzatech kann auch Isopropanol, Aceton, Butandiol, Butanol, Bernsteinsäure, Isopren oder sogar PET mithilfe seiner proprietären Mikroorganismen aus Synthesegas bereitstellen4,5. Daneben hat das Unternehmen Evonik einen Prozess entwickelt, in dem über Gasfermentation die Lösungsmittel Hexanol und Butanol hergestellt werden können6,7. Diese Beispiele unterstreichen ein enormes Potenzial für die Einsparung und Verwertung von Treibhausgasen bei der Produktion dieser verschiedenen und wichtigen chemischen Grundstoffe.
Aber die Gasfermentation hat auch Nachteile. Die Handhabung und Speicherung des gasförmigen Substrats ist mit Risiken verbunden, da CO (Kohlenmonoxid) für den Menschen giftig ist. Zudem ist der Gaseintrag in das flüssige Nährmedium für die Mikroorganismen begrenzt durch die geringe Löslichkeit der Gaskomponenten. Deswegen traten auch in den letzten Jahren flüssige Substrate, die aus CO2 gewonnen werden können, wie Ameisensäure und Methanol, in den Vordergrund. Diese Substrate lassen sich einfach handhaben und speichern sowie gut in konzentrierter Form in den Bioreaktor zudosieren.
Bioplastik aus Ameisensäure hergestellt
Ameisensäure wird seit ein paar Jahren als biotechnologisches Substrat der nächsten Generation gehandelt8. Der Grund ist die einfache Herstellung über elektrochemische Prozesse direkt aus CO2 oder über die katalytische Oxidation aus Biomasse.9,10 Somit wird ein weiterer Ausgangsstoff zugänglich, mit dem CO2 indirekt über Fermentation als Rohstoff genutzt werden kann.
Akteure der biotechnologischen Ameisensäure-Verwertung sind Bakterien, die diese Verbindung umsetzen können. Sie besitzen spezielle Eigenschaften im Stoffwechsel, die es ermöglichen, diese organische Säure, bestehend aus einem Kohlenstoffatom, effizient zu assimilieren. Beispiele für bekannte Mikroben mit diesen Eigenschaften sind Cupriavidus necator, Acetobacterium woodii oder Methylorubrum extorquens. Allerdings wurde bisher nur ein Bruchteil der möglichen Produkte erschlossen. Veröffentlichte Beispiele beschränken sich auf die Produktion natürlicher mikrobieller Speicherstoffe wie Polyhydroxyalkanoate (PHA), die als Bioplastik genutzt werden können11. Aber es befinden sich zahlreiche Forschungsprojekte zur Produktion von Aminosäuren, organischen Säuren, Polymerbausteinen oder Farbstoffen in Arbeit, auch beim Fraunhofer IGB, und man darf gespannt sein, welche Produkte in Zukunft durch dieses Verfahren hergestellt werden können.
Bis heute gibt es noch keinen kommerziellen Fermentationsprozess, der Ameisensäure als Substrat nutzt. Aber das soll sich in Zukunft ändern. In Deutschland hat sich, neben dem Fraunhofer IGB, ein Unternehmen auf die Entwicklung dieser Technologie spezialisiert: Die b.fab GmbH12. Im Zentrum steht ein patentierter , der mithilfe der synthetischen Biologie dazu gebracht wurde, Ameisensäure zu verwerten. Die einfache Handhabung und die vielfältigen gentechnischen Werkzeuge für E. coli lassen diese Strategie vielversprechend erscheinen, um zukünftig zahlreiche Produkte aus Ameisensäure herzustellen.
Methanol als Grundlage einer gesunden Ernährung?
Eine weitere spannende Möglichkeit ist der Einsatz von Methanol als biotechnologisches Substrat. Auch diese Verbindung lässt sich mit einfachen chemischen Prozessen aus CO2 herstellen. Ein weiterer Vorteil ist, dass Methanol eine sehr hohe Energiedichte besitzt: 22,7 MJ pro Kilogramm. Im Vergleich dazu besitzt Ameisensäure nur einen Brennwert von 5,5 MJ pro Kilogramm13,14. Somit ist Methanol ein vielversprechendes Substrat der nächsten Generation für die Fermentation.
Auch für biotechnologische Prozesse mit Methanol sind Mikroorganismen die Schlüsselakteure. Mikroben, die Methanol verwerten können, finden sich hauptsächlich unter den methylotrophen oder methanotrophen Mikroorganismen. Beispielhaft sind Bakterien wie Methylorubrum extorquens, Methylobacterium mesophilicum oder Bacillus methanolicus zu nennen. Daneben gibt es auch methylotrophe Hefen wie Pichia pastoris, die häufig für die Proteinproduktion eingesetzt werden15. Gemeinsam haben diese Mikroorganismen, dass die Verstoffwechselung von Methanol ähnlich abläuft und entweder Ameisensäure oder Formaldehyd als Metabolit auftritt. Deswegen können viele methylotrophe Mikroben auch Ameisensäure verwerten.
Die Fermentation mit Methanol als Ausgangsstoff erlebte in den 1980er Jahren eine Hochzeit. Zu dieser Zeit waren viele Firmen aktiv, die dieses im Überschuss vorhandene Substrat zu Einzellerprotein umsetzen und für die menschliche oder tierische Ernährung nutzen wollten. Mit der Ölkrise der 70er und 80er Jahre und durch die Nutzung von Sojaprotein abgelöst.15 Doch bei einer steigenden Weltbevölkerung und mit der einfachen Herstellung von Methanol aus CO2 werden diese Ansätze wieder hochinteressant.
Aber nicht nur Proteine als Nahrungsmittel sind von Interesse. Insbesondere B. methanolicus ist als Aminosäure-Produzent bekannt. Es wurden bereits Beispiele veröffentlicht, in denen große Mengen an l-Glutamat oder l-Lysin mit diesem Bakterium produziert werden konnten16. Diese beiden Aminosäuren sind als Nahrungsmittelzusatz oder als Futtermittel-Aminosäure prominent vertreten – mit Märkten im Millionentonnen-Maßstab pro Jahr.
Daneben setzt die Forschung verstärkt auf die genetische Modifikation dieser Mikroorganismen, um weitere spannende Produkte aus Methanol zu produzieren. Beispielhaft sind hier organische Säuren wie Mesaconate zu nennen. Noch vielversprechender ist die Demonstration der 1,5-Diaminopentan-Produktion mit B. methanolicus. Dadurch können Hochleistungspolymere in Reichweite gelangen, die letztlich aus CO2 bestehen.17
Diese Vielfältigkeit an möglichen Produkten und die voranschreitende Forschung an den Mikroorganismen macht die methylotrophe Fermentation zukünftig zu einem Trendthema für die immer wichtiger werdende CO2-Nutzung und das nahende Ende vom fossilen Zeitalter.
Auch das Fraunhofer IGB ist im Bereich der methylotrophen Fermentation und der zugehörigen Stammentwicklung erfolgreich. Wenn Sie unser Produkt- und Prozessportfolio interessiert, dann kontaktieren Sie mich gerne. Weitere Informationen zu unseren Arbeiten gibt es im kommenden Beitrag und unter den Links.
Weiterführende Links:
- Nachhaltige katalytische Prozesse – Biokatalysatoren
- Biotechnologische Produktion organischer Säuren aus Methanol
- CELBICON – Kosteneffiziente Umwandlung von Kohlenstoffdioxid in Chemikalien
- Methylotrophe Hefen für die industrielle Biotechnologie
Verwendete Referenzen:
1 https://lanzatech.com/
2 Hoang, T.-D.; Nghiem, N. Recent Developments and Current Status of Commercial Production of Fuel Ethanol. Fermentation 2021, 7, 314. https://doi.org/10.3390/fermentation7040314
3 Ou, X., Zhang, X., Zhang, Q. et al. Life-cycle analysis of energy use and greenhouse gas emissions of gas-to-liquid fuel pathway from steel mill off-gas in China by the LanzaTech process. Front. Energy 7, 263–270 (2013). https://doi.org/10.1007/s11708-013-0263-9
4 http://www.arpae-summit.com/paperclip/exhibitor_docs/16AE/LanzaTech_Inc._701.pdf (zuletzt aufgerufen am 05.07.2022)
6 https://corporate.evonik.com/de/kuenstliche-photosynthese-aus-elektrolyseur-und-bioreaktor-macht-co2-zum-rohstoff-einer-erfolgreiche-145987.html
7 Haas, T., R. Krause, R. Weber, M. Demler, and G. Schmid. Technical photosynthesis involving CO2 electrolysis and fermentation. Nature Catalysis, 2018. 1(1): p. 32-39. https://doi.org/10.1038/s41929-017-0005-1
8 Yishai, O., S.N. Lindner, J. Gonzalez de la Cruz, H. Tenenboim, and A. Bar-Even. The formate bio-economy. Current Opinion in Chemical Biology, 2016. 35: p. 1-9. https://doi.org/10.1016/j.cbpa.2016.07.005
9 Bohlen, B., D. Wastl, J. Radomski, V. Sieber, and L. Vieira. Electrochemical CO2 reduction to formate on indium catalysts prepared by electrodeposition in deep eutectic solvents. Electrochemistry Communications, 2020. 110: p. 106597. https://doi.org/10.1016/j.elecom.2019.106597
10 https://www.oxfa.eu/technologie/
11 Chang, W., Yoon, J. & Oh, MK. Production of Polyhydroxyalkanoates with the Fermentation of Methylorubrum extorquens Using Formate as a Carbon Substrate. Biotechnol Bioproc E 27, 268–275 (2022). https://doi.org/10.1007/s12257-021-0218-7
13 https://webbook.nist.gov/cgi/cbook.cgi?ID=C67561&Mask=2
14 https://webbook.nist.gov/cgi/cbook.cgi?ID=C64186&Mask=2
15 Fabarius, J.T., V. Wegat, A. Roth, and V. Sieber, Synthetic Methylotrophy in Yeasts: Towards a Circular Bioeconomy. Trends in Biotechnology, 2021. 39(4): p. 348-358. https://doi.org/10.1016/j.tibtech.2020.08.008
16 Brautaset, T., Jakobsen, Ø.M., Josefsen, K.D. et al. Bacillus methanolicus: a candidate for industrial production of amino acids from methanol at 50°C. Appl Microbiol Biotechnol 74, 22–34 (2007). https://doi.org/10.1007/s00253-006-0757-z
17 Pfeifenschneider, J., T. Brautaset, and V.F. Wendisch, Methanol as carbon substrate in the bio‐economy: Metabolic engineering of aerobic methylotrophic bacteria for production of value‐added chemicals. Biofuels, Bioproducts and Biorefining, 2017. 11(4): p. 719-731. https://doi.org/10.1002/bbb.1773